作者:杨怀涛、薛德彬、陶祥、李再波、赵澄泉
原标题:《人乳头状瘤病毒检测阴性的子宫颈癌》
来源:《中华病理学杂志》2015年,44卷(1期)
子宫颈癌是女性最常见的恶性肿瘤之一。发达国家采用宫颈细胞学筛查已有60多年历史,子宫颈癌的发生率和病死率均明显降低,现在85%的新发病例出现在发展中国家。一般认为高危型人乳头状瘤病毒(human papillomavirus,HPV)感染是子宫颈癌发生的必要因素,所以HPV检测已被广泛纳入子宫颈癌的筛查方案。
例如对细胞学诊断不典型鳞状细胞(ASC-US)的患者再进行HPV检测以进一步分类指导治疗;对≥30岁的妇女可以进行细胞学和HPV联合检测。2014年4月,美国食品和药品管理局(FDA)首次通过了单独应用Roche cobas HPV检测筛查25岁以上女性的子宫颈癌,突显了高危型HPV检测在子宫颈癌筛查中的地位。
高危型HPV检测之所以可以普遍甚至独立应用于子宫颈癌筛查,是基于高危型HPV与子宫颈癌密切相关。然而许多临床研究表明有一定比例的子宫颈癌患者的组织标本HPV检测呈阴性,其中包括真阴性(即确实存在与高危型HPV无关的宫颈癌)和假阴性(因取材不当或现有检查方法无法检测出标本中仅有的低滴度、低拷贝数的HPV)。
如果采用细胞学和高危型HPV双检测、筛查周期延长至5年1次或以高危型HPV检测作为子宫颈癌唯一的筛查方法,就有漏诊和延误治疗的可能。本文在复习相关文献资料的基础上,探讨HPV检测阴性的子宫颈癌这一问题及其在子宫颈癌筛查和临床诊治中的意义。
1.子宫颈液基标本HPV检测:
最早获得美国FDA批准的HPV检测方法是杂交捕获试验2(HybridCapture 2,HC2,Qiagen公司)。新研发的HPV检测方法一般均要与HC2方法比对,并至少达到HC2的特异性和敏感性。然而,多项子宫颈癌患者细胞学标本研究均显示HC2存在不同比例的阴性率。
Poljak等显示斯洛文尼亚的子宫颈癌HC2阴性率为12.6%。中国广东省和浙江省子宫颈癌的HC2阴性率分别为10.1%和5.0%。韩国的阴性率相似(鳞状细胞癌为5.2%、浸润性腺癌为11.6%)。澳大利亚的HC2于鳞状细胞癌组织学诊断前30个月时,HPV阴性率是8%,而子宫颈腺癌高达4/5。美国匹兹堡大学医学中心结果显示,约10%(3/31)子宫颈鳞状细胞癌患者在诊断前1年内有1次HC2阴性结果。14%(4/29)子宫颈腺癌(原位腺癌/浸润性腺癌)患者在组织学诊断前3年中有过HC2检查阴性历史。美国病理学家学会细胞学委员会组织的多中心研究观察了70例子宫颈癌患者在组织学诊断的前1年内和前1~3年HPV检测,其阴性发生率分别为9%、25%。
上述结果表明单用HPV检测筛查子宫颈癌有严重的局限性。细胞学标本检测HPV可以出现假阴性,造成假阴性的原因可能有:(1)检测方法未包括所有类型的高危型HPV;(2)标本中仅有低滴度或低拷贝数的HPV;(3)标本中存在化学反应抑制物;(4)HC2检测方法敏感性不足;(5)标本取材不满意;(6)其他未知因素等。
2.子宫颈组织学标本HPV检测:
基于PCR方法的HPV检测及分型技术进步很快。大多数PCR技术使用退行性引物和/或通用引物扩增,然后对扩增产物作进一步分析确定HPV的亚型。最常用的PCR分析方法通过扩增HPV L1、E1或E6/E7区域。使用退行性引物和/或通用引物扩增的优点是通过一次PCR扩增即可检测出多种亚型的HPV。
近年研发的LiPA25分析(荷兰Labo生化医学产品公司)使用SPF-10广谱引物进行PCR扩增后,再使用线性探针进行反向杂交,达到基因分型的目的,可同时检测25种不同的高危和低危型HPV。
一项国际性回顾研究采用LiPA25方法分析了来自38个国家的共10575例浸润性宫颈癌病例,结果显示1598例(15%)为HPV DNA阴性。其中包括1234例鳞状细胞癌、290例腺癌、36例腺鳞癌和38例罕见组织学类型的浸润性子宫颈癌(包括未分化癌、神经内分泌癌、非特殊型癌、腺样基底细胞癌和腺样囊性癌)。
HPV阴性的原因主要是技术问题(DNA降解和PCR检测效率的限制),约占60%的HPV阴性病例。病毒含量过低也可能是原因之一。另外Gheit和Tommasino提出了一种基于E7 PCR的分析方法,用于检测甲醛固定、石蜡包埋标本中的广谱HPV类型。其优势是兼有多重PCR方法的高度敏感性和Sanger测序法相似的特异性。这种基于E7 PCR分析HPV方法的特异性有赖于一种阵列引物扩展分析技术,可以检测37种不同的高危和低危型HPV亚型。Hopenhayn等用该方法对777例组织学确诊的浸润性子宫颈癌的HPV进行检测,也观察到9%的阴性率。Giorgi等分析574例浸润性子宫颈癌标本HPV感染状况。实验采用GP5+/P6+引物方法、LiPA25及Qiagen Multiplex PCR试剂盒检测HPV DNA,结果显示24例浸润性子宫颈癌为HPV阴性,阴性率为4.2%;2013年Tjalma等引报道了17个欧洲国家应用SPF1O-DEIA(DNA酶免疫分析)/LiPA25 PCR系统检测3162例浸润性子宫颈癌病例的HPV,结果显示8.2%的浸润性子宫颈癌为HPV阴性;de Sanjose等基于10575例浸润性子宫颈癌病例,其中1598例(15%)为HPV DNA阴性,多为年长患者和非鳞状细胞癌患者。在美国,子宫颈鳞状细胞癌的发病率明显下降,但宫颈腺癌的绝对和相对发病率均呈增加趋势,占全部子宫颈癌的10%~25%。
2014年4月,Modern Pathology杂志线上发表了一份关于宫颈腺癌及其亚型组织学标本HPV基因分型的大宗研究报告。作者用SPF-10广谱引物PCR方法结合DNA酶免疫实验检测HPV。HPV基因分型用LiPA25方法。682例宫颈腺癌标本,总的HPV阴性率为37.2%。其中典型(普通型)宫颈腺癌HPV阴性率为28.2%(160/567),非特殊型腺癌为86.1%(31/36),透明细胞癌为80%(24/30),浆液性腺癌为75%(18/24),微偏腺癌为11/12,子宫内膜样宫颈腺癌为8/11,混合性浆液和透明细胞癌为2/2。在所有的115例非典型的宫颈腺癌病例中,HPV阴性率高达为81.7%(94/115)。换言之,大约82%的非典型/或非普通型子宫颈腺癌HPV检测阴性。
An等综合报道了来自韩国研究资料显示宫颈腺癌总的HPV阴性率是10%。微偏腺癌极少与HPV感染有关,其HPVDNA阴性检出率有3/4。Houghton等应用HPV基因分型的线性芯片分析,结果显示9/40(22%)的普通型腺癌HPV阴性,而微偏腺癌3例、胃型3例、肠型3例、中肾型2例、透明细胞型3例、宫颈肝样癌1例均为HPV阴性。与此结果相似,Kusanagi等用多重PCR试剂盒(加拿大Qiagen公司)检测16种HPV亚型,结果显示7例胃型宫颈腺癌HPV阴性。Park等对26例少见亚型的宫颈癌进行了检测,其中透明细胞癌9例、胃型腺癌11例、微偏腺癌3例、中肾腺癌1例、浆液性腺癌1例和恶性中胚叶混合瘤1例,所有病例采用SPFl0PCR和LiPA法检测,除1例浆液性癌HPVl6型为阳性外,其余HPV检测皆为阴性。Kenny等用HPV基因分型的线性阵列方法检测7例宫颈中肾管腺癌病例,HPV全为阴性。表1总结文献资料中非典型或少见类型与宫颈腺癌HPV检测结果。

3.HPV阴性的子宫颈癌:
大量细胞学和组织学研究结果说明存在着HPV阴性的宫颈癌,包括少部分鳞状细胞癌、普通型腺癌、其他亚型的腺癌以及罕见类型的癌。这便对宫颈癌发生的传统观念提出了挑战。一般认为HPV DNA几乎存在于所有的子宫颈浸润性癌,即宫颈上皮受高危HPV感染后,自上皮内瘤变经原位癌最终发生浸润性癌的发生模式,引导我们得出不存在HPV阴性的子宫颈癌的错误结论。
1.挑战——FDA最新批准Roche cobas HPV检测用于宫颈癌一线初级筛查方法:可以对高危型HPVl6、18和其他12个亚型进行分型检测,筛查步骤包括:如HPVl6和/或18型阳性,可进行阴道镜检查;如果其他12型高危HPV阳性者,则行子宫颈细胞学检查进行评估,以决定是否需要进行阴道镜检查。这是首次将HPV检测放在宫颈癌筛查的主导地位,将对美国或其他国家子宫颈癌筛查引起重大的影响。
2.争议——HPV作为子宫颈癌一线初级筛查筛查方法的不足:cobas HPV被批准作为子宫颈癌筛查的主要方法后,美国妇科和病理学界对此存广泛争议,争议焦点在于存在一定比例的HPV阴性子宫颈癌和HPV检测假阴性。单一的HPV检测必然会造成部分宫颈癌患者的漏检。另外,80%~90%的HPV感染者在1~2年内可以完全自然转阴,可能造成过度治疗。目前美国对宫颈癌的筛查有3种选择:细胞学筛查(≥21岁)、细胞学和HPV共同检查(≥30岁)和cobas HPV筛查(≥25岁)。在美国,临床上一般应用FDA认证和通过的HPV检测方法。
由于HPV检测作为主要筛查方案刚获得FDA通过,Roche公司ATHENA临床试验资料显示cobas HPV检测对CIN 3+病变敏感性较低(58.6%)。2012版美国子宫颈癌筛查指南及美国阴道镜和子宫颈病理学会对异常宫颈细胞学的临床处理指南还没有将HPV检查作为唯一的筛查方法,所以现在的方案并没有应用于临床。我们认为用HPV检测作为子宫颈癌一线初级筛查方案的优劣仍然需要时间来验证。大多数妇科和病理学专家还是建议结合宫颈细胞学和HPV共同检测方法对30岁以上妇女进行子宫颈癌筛查。美国子宫颈癌筛查指南推荐对共同检测双阴性妇女的筛查周期可以放宽至5年。但考虑到诊断浸润性宫颈癌前的3~5年期间相当多的妇女有细胞学和HPV检查结果为阴性,5年的筛查周期可能过长,需要大量、长期的临床资料和结果来验证。
中国子宫颈癌筛查起步较晚,虽然近年发展很快,但存在一些问题:(1)细胞病理医师和技师的培养体制不完善;(2)尚无全国统一制定的细胞学质量检查和控制标准;(3)中国妇女(尤其是经济条件较好地区的女性)行HPV检测的主要目的是筛查子宫颈癌,只有少部分HPV检测是因异常子宫颈细胞学结果(如ASC-US)而做;(4)国内有许多检查项目包括多种HPV分型(包括低危HPV)的检测,然而低危HPV感染与子宫颈癌无任何的相关性,美国病理医师学院(CAP)规定低危HPV的检测不应该用于子宫颈癌的筛查;(5)相对较大比例的中国妇女从未接受过子宫颈癌的筛查;(6)中国目前子宫颈癌筛查方案和筛查人群与美国有许多的不同。
所以,对于子宫颈癌筛查和临床处理,我们可以借鉴国外的经验,但不可能全部照搬国外的条文。中国也应该由多个学科(如妇科、病理科、流行病学等)组成专家团队根据国内的现状、相关研究成果和经验来制定一套适合中国的子宫颈癌筛查方案以及临床处理治疗指南。
综上所述,研究资料显示大约有10%的子宫颈腺癌和一定比例的子宫颈鳞癌HPV检测为阴性。与子宫颈鳞状细胞癌相比,子宫颈腺癌的HPV检出率较低,但类型相似,即HPVl6和18仍然是最常见类型,且HPVl8在子宫颈腺癌中阳性的比例高于子宫颈鳞癌。尤其值得注意的是大多数非普通型子宫颈腺癌,例如微偏腺癌、胃型、肠型、中肾管型、透明细胞型、浆液性腺癌可能与HPV感染无关。
除了一些由于检测方法和样本取材等所造成的假阴性外,也有一定比例的HPV阴性子宫颈癌,其可能具有不同于HPV致癌的肿瘤发生途径。类似于外阴上皮内瘤变的HPV非依赖性的p53相关的肿瘤发生途径。但是鉴于相关研究很少,其分子机制尚未充分阐明。另外,根据病变发展过程子宫颈癌可分为I型和Ⅱ型。Ⅱ型子宫颈癌的病程进展快速,容易在筛查过程中被疏漏,其中可能包括部分HPV阴性子宫颈癌。
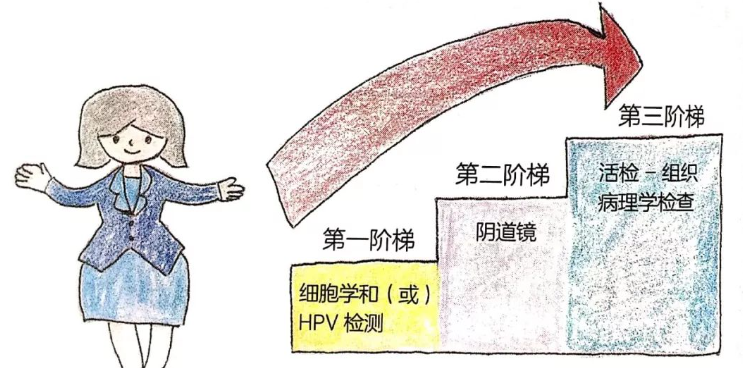
子宫颈癌筛查中HPV检测和细胞学检查有什么区
什么是子宫颈细胞学子宫颈细胞学是筛查早期子宫颈癌和癌前病变的(0)人阅读时间:2023-07-23
【基因检测】丨基因分析检测子宫癌症与治疗
1.基因检测就是给自己一份“身体使用说明书”对于大多数健康人来(1)人阅读时间:2023-07-23
子宫癌越来越年轻,身体发出这些“警报”要小心
为什么年纪轻轻就得了子宫癌?哪些人容易得这个病?怎样发现身体的(0)人阅读时间:2023-07-11
子宫癌肉瘤诊治中国专家共识(2020年版)
子宫癌肉瘤 (uterine carcinosarcomas,UCS)仅占所有子宫体恶性肿(0)人阅读时间:2023-07-11基因检测的5大误区
 检测结果的高危人群仅表明这类人群属于该病的易感人群,在有害环境因素的影响下比正常人群更容易患该病,并不意味着一定会患该病。..2023-12-27
检测结果的高危人群仅表明这类人群属于该病的易感人群,在有害环境因素的影响下比正常人群更容易患该病,并不意味着一定会患该病。..2023-12-27个性化遗传心肌病的下一步建议
 特征的基因特异性心脏纤维化模式使心脏磁共振成为FLNCtv携带者的有前途的筛查工具,而不是只能检测收缩功能异常的超声心动图。..2023-12-21
特征的基因特异性心脏纤维化模式使心脏磁共振成为FLNCtv携带者的有前途的筛查工具,而不是只能检测收缩功能异常的超声心动图。..2023-12-21牙表面出现凹坑可能是遗传变异导致的
 AI表型与近乎正常厚度的牙釉质一致,可出现表面凹凸不平的可变局灶性低形成。..2023-12-21
AI表型与近乎正常厚度的牙釉质一致,可出现表面凹凸不平的可变局灶性低形成。..2023-12-21科学家对基因组检测在罕见病诊断中的现状与发展趋势的深度思考
 我们还需要改变一种长期以来依赖的模式,那就是我们“对着”患者进行研究,而不是“与”患者共同进行研究。..2023-12-21
我们还需要改变一种长期以来依赖的模式,那就是我们“对着”患者进行研究,而不是“与”患者共同进行研究。..2023-12-21